2022硫辛酸医疗用途科研进展
by 孙大潍
α硫辛酸(Alpha-lipoic acid)也叫做硫辛酸或辛酸,是一种强大的抗氧化剂。它首次被科学家发现是在1937年,并在1951年被从体内分离出来[1][2], 距今已经过去将近100年。这100年来,科学家对它对人体的作用的研究一直没有间断过,新的生理作用每隔一段时间就会被发现;尤其是自2000以来,由于它在的肾的保护等方面的突出作用,再次成为了研究热点。本文回顾自2000年以来关于硫辛酸的研究进展,介绍硫辛酸(ALA)在糖尿病患者神经病变、肥胖症、中枢神经系统相关疾病和妊娠异常中的应用。
1. 物理特性和作用机理
硫辛酸结构简单,是辛酸的6位和8位氢原子被巯基取代的产物,所以中文称为硫辛酸。英文以前称为thioctic acid,现在为了与其它含硫化合物区分,统一称为lipoic acid(LA)。在生化反应中,硫辛酸最主要的功能是作为酰基载体,参与α-酮酸脱羧反应。其6位的巯基可以运载α-酮酸脱羧后产生的酰基,与辅酶A相似。其实反应的最后步骤就是将这个酰基再转移给辅酶A。糖代谢中的丙酮酸脱氢酶,还有三羧酸循环中的α-酮戊二酸脱氢酶都是这样。在丙酮酸脱氢酶复合体中,E2分子中赖氨酸侧链和硫辛酰胺一起构成一条“手臂”,在电荷的推动下携带中间产物(乙酰基)移动,最后生成乙酰辅酶A。α-酮戊二酸脱氢酶的反应机制与之类似。这两个反应所在的代谢途径是人体能量代谢的中心环节,所以硫辛酸是不可或缺的。
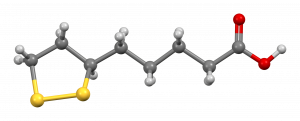
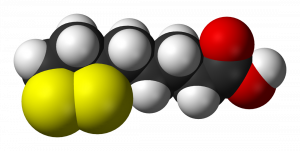
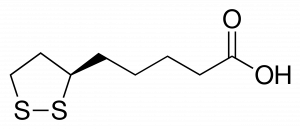
在Krebs Cycle中,ALA在各种化学反应中发挥着重要的作用,作为一些参与细胞能量生成的酶复合体的辅助因子。它还与蛋白质形成共价键,具有治疗潜力。它有一个单一的手性中心和不对称的碳,导致两种光学异构体: R-和S-硫辛酸(图1)[3]。因此,ALA有两种对映体形式,称为S和R对映体,被认为是彼此的镜像。S和R对映体在ALA中同样存在,但R对映体是自然存在的,而S对映体是通过化学过程制备的。食物是R对映体的天然来源,在生物体内自然产生,与蛋白质形成共价键。虽然ALA在自然界中以R型对映体的形式存在,但合成补充剂由R型和S型的外消旋体组成[4]。尽管人体合成的数量不多,但产生的ALA数量不足以满足细胞的能量需求。
另一方面,ALA在临床上有许多有价值的特性[5,6]。它作为一种酶的辅助因子[7],也参与葡萄糖[8,9]和脂质[10]的代谢并管理基因转录。ALA还具有抗氧化作用,因为它不仅能改善而且能恢复内在的抗氧化系统,并支持其生产或细胞的可及性[11,12,13]。它还能有效地清除血液中的重金属,这些重金属是造成氧化压力的原因[11,13,14]。与其他抗氧化物质相比,ALA最独特的特点是它可以作为脂质和水溶性化合物进行反应[5,6]。毫无疑问,它是一种强有力的抗氧化剂,但由于某些原因,它被禁止用于医疗目的;然而,在一些州,它被用作补充剂,在另一些州被用作补救措施[5,6,15]。这些限制是由于物质本身的一些内源性特征,如由于二硫环的披露和分子间二硫键的出现而产生的变化性。限制ALA口服使用的其他特性是它在胃肠道中溶解的能力下降和肝脏代谢率增加。此外,除了广为人知的抗氧化潜力外,ALA还具有许多其他功能,因为它参与线粒体产生能量,充当参与代谢的各种酶的辅助因子[5]。
此外,ALA在新陈代谢过程中对葡萄糖的调节起着重要作用。例如,ALA已被用作糖尿病多发性神经病变相关的疼痛和麻痹的外消旋药物[16]。ALA在通过线粒体进行能量转导方面也有重要功能[6,17]。在ALA的小分子中存在两个还原或氧化的硫醇基团。氧化形式被称为ALA或简称为硫辛酸,而还原形式被称为二氢硫辛酸(DHLA)。ALA能使自由基失活,而还原形式也能与活性氧(ROS)发生作用[8]。自然地,ALA在线粒体中被发现,它与E2亚基结合,并被用作丙酮酸脱氢酶(PDH)和α-酮戊二酸脱氢酶复合体的辅助因子[18]。ALA在体内由半胱氨酸和脂肪酸从头合成,数量非常少,因此需要从外源性来源补充[19]。
ALA可以改善血糖控制[6],减轻糖尿病(DM)并发症[20,21],甚至周围神经病变的症状,同时有效地减少重金属的毒性[22]。
2. 生理作用
多年来,ALA作为一种食品添加剂获得了相当大的关注,在治疗或管理几种疾病方面都具有有益的作用[11,34,35]。ALA的药理作用主要与它的抗氧化活性有关,但ALA和DHLA也表现出有趣的心血管、认知、抗衰老、解毒、抗炎、抗癌和神经保护特性[35]。
2.1. α-硫辛酸的抗氧化潜力
关于ALA和DHLA的抗氧化作用有大量的文献资料,即作为金属螯合剂、自由基清除剂、内源性抗氧化剂(如谷胱甘肽、维生素C和E)的再生剂和修复氧化损伤[36]。ALA中硫醇基团的存在是其金属螯合能力的原因[14,35]。此外,它能够提高细胞内的谷胱甘肽水平,从而螯合和排泄各种毒素,特别是体内的有毒金属[35]。例如,Goralska等人[37]的研究表明,ALA的服用导致上皮细胞中铁离子的减少。这种变化与细胞对过氧化氢挑战的抵抗力提高有关,这意味着ALA在减少氧化应激方面发挥了直接影响[37]。简而言之,ALA被认为是一种生物抗氧化剂,它既是水溶性的,也是脂溶性的,能够中和身体各处、细胞内外的ROS,由于这个原因,ALA被称为通用的抗氧化剂[38,39,40]。
2.2. α-硫辛酸的抗糖尿病潜力
在代谢性疾病中,糖尿病(DM)是一个严重的健康问题,目前影响着全球约4.22亿人[41]。它是由碳水化合物、脂质和蛋白质代谢紊乱引起的[42]。此外,它还被认为是几种人类疾病发展的主要风险因素,包括动脉粥样硬化、高血压、心力衰竭、心肌梗塞、神经性疼痛,甚至中风[43]。新的证据表明,DM是由过度的ROS生成和抗氧化潜力的损害造成的[44,45,46]。一些研究强调了ALA在糖尿病中的潜在用途,因为它能够增加胰岛素敏感和胰岛素抵抗的肌肉组织对糖的吸收[4,47],并通过将葡萄糖转运体重新分配到质膜上,以及胰岛素受体底物-1的酪氨酸磷酸化来刺激葡萄糖的吸收[9]。
2.3. α-硫辛酸与阿尔茨海默病
阿尔茨海默病(AD)是一种以认知、功能和行为改变为特征的神经系统疾病。记忆力下降与β-淀粉样蛋白斑块的形成以及AD患者病理形式下tau的上升有关[48,49]。大量的证据支持氧化应激在AD发病机制中的作用[50,51,52]。非甾体抗炎药(NSAIDs)已被提议用于治疗神经退行性疾病,包括AD。然而,由于环氧化酶(COX)受到抑制,长期服用NSAIDs会导致胃肠道的毒性[35,53]。为了克服这一限制,根据氧化应激在AD发展中的预期作用,ALA被选中。
体外调查表明,ALA对Aβ介导的细胞毒性具有神经保护作用[54,55,56],即通过保护皮质神经元免受Aβ或H2O2诱发的细胞毒性的影响[57],部分原因是PKB/Akt信号通路的激活。另一项研究显示,ALA能够有效地保护培养的海马神经元免受Aβ肽和Fe/H2O2介导的毒性影响[58]。
研究还表明,ALA通过激活胆碱乙酰转移酶来增加乙酰胆碱(ACh)的产生,从而增加葡萄糖的吸收,从而为ACh的产生提供更多的乙酰CoA,显示出抗痴呆或抗AD的特性[59]。Haugaard和Levin(2000)报告说,DHLA明显增加了纯化的胆碱乙酰转移酶的活性,通过透析从部分纯化的胆碱乙酰转移酶中去除DHLA,导致酶的活性完全消失,加入DHLA可以使活性恢复到正常水平。用大鼠大脑和心脏以及兔膀胱组织的提取物重复实验时,也得到了同样的发现。因此,作者得出结论,它可能在胆碱乙酰转移酶反应中充当一种辅酶[60]。
另一方面,炎症在AD中具有关键功能。它在淀粉样斑块周围活动,被激活的星形胶质细胞和小胶质细胞所包围,其特点是自由基和促炎症细胞因子的水平升高[61],其中TNF-α被认为是从轻度认知障碍到AD的一个指标[59,62]。ALA在这方面有多种复杂的作用,即清除ROS、过渡金属离子,增加还原型谷胱甘肽的水平[59,63],清除脂质过氧化产物[62,64,65],甚至作用于信号传导途径[63,66]。同样,Dinicola等人[67]发现ALA通过DNA甲基化依赖性调控,降低了SK-N-BE人类神经母细胞瘤细胞中的炎症细胞因子IL-1B和IL-6的水平,为表观遗传机制在AD控制/预防方面的影响铺平了道路。
2.4. α-硫辛酸与癌症
越来越多的文献强调ALA在癌症治疗中的潜在应用[68,69]。癌细胞优先将葡萄糖转化为乳酸以产生ATP,这种现象被称为沃伯格效应或有氧糖酵解。癌细胞中有氧糖酵解的持续激活导致致癌基因的激活或肿瘤抑制因子的丧失,从而引起癌症的进展。在这方面,对有氧循环的抑制可能有助于抗癌效果[70,71]。丙酮酸脱氢酶催化丙酮酸向乙酰CoA的转化,从而防止乳酸的产生。Feuerecker等人研究了ALA是否能够激活肿瘤细胞中的丙酮酸脱氢酶。结果显示,在神经母细胞瘤细胞系Kelly、SK-N-SH、Neuro-2a和乳腺癌细胞系SkBr3中,ALA抑制了细胞增殖、[18F]-FDG摄取和乳酸形成,并增加了细胞凋亡。在皮下SkBr3细胞的小鼠异种移植模型中,每天用ALA治疗可以延迟肿瘤的生长[72]。
在BCPAP、HTH-83、CAL-62和FTC-133细胞系中,ALA通过激活AMPK和随后下调mTOR-S6信号通路抑制了甲状腺癌细胞的增殖和生长。在同一研究中,还发现ALA在使用BCPAP和FTC-133细胞的小鼠异种移植模型中也明显抑制了肿瘤的生长[73]。在肺癌细胞中,ALA通过Grb2介导的EGFR下调抑制了细胞增殖[74]。
研究还表明,ALA能够产生ROS,促进肺癌[75]、乳腺癌[76]和结肠癌[77,78]中ALA依赖性的细胞死亡,这表明它能触发癌细胞中的线粒体凋亡途径。最近,人们评估了ALA对乳腺癌细胞迁移和侵袭的影响[79]。结果表明,ALA抑制了转移性乳腺癌细胞的迁移和侵袭,部分是通过ERK1/2和AKT信号传导。总之,科学数据表明,ALA可以应用于癌症管理和预防。
3. 临床应用
3.1. α-硫辛酸的抗糖尿病特性
如前所述,ALA已被证明对增加胰岛素敏感和胰岛素抵抗的肌肉组织中的糖的摄取有帮助[4,47]。此外,甘油三酯在体内的储存导致了2型DM的发展。当激活时,AMP-激活蛋白激酶(AMPK)会增加糖的摄取,脂肪酸的氧化和线粒体的生物生成。在肥胖大鼠中,肌肉AMPK水平降低。然而,当这些大鼠被提交给ALA时,观察到在骨骼肌和整个身体中胰岛素刺激的葡萄糖处置的提高。还发现ALA能增加脂质氧化和激活AMPK。这些结果表明,ALA通过AMPK的激活改善了胰岛素的敏感性[80]。Konrad等人[9]已经证明,ALA通过将葡萄糖转运体重新分配到质膜,以及胰岛素受体底物-1的酪氨酸磷酸化来刺激葡萄糖的吸收。在Bitar等人进行的一项研究中[81],发现通过信号转导途径,摄入50毫克/千克,持续30天,可以避免糖尿病引起的大鼠线粒体和内皮功能紊乱。众所周知,在DM中,通过调节内皮一氧化氮合成酶(eNOS)的活性和氧化应激,NO的生物利用率降低[82]。在老年大鼠的内皮细胞中,ALA的摄入导致eNOS的磷酸化通过Akt而减少[83]。在人脐带血管内皮细胞和THP-1人单核细胞系中,ALA能够引发Akt的磷酸化[84,85]。这些发现提出,由于ALA引起的内皮功能的改善部分归因于eNOS的重新耦合和NO生物利用度的增加[82]。因此,ALA作为DM管理的辅助剂,与它抑制产生自由基的糖化的能力有关[82,86,87]。总的来说,这里积累的信息表明ALA对DM的治疗具有潜在的治疗价值。
3.2. α-硫辛酸和阿尔茨海默病
鉴于以上强调的ALA用于神经退行性疾病的方面,特别是用于AD,Quinn等人[88]评估了补充ALA的饮食对老年Tg2576小鼠AD的海马依赖性记忆的影响。作者发现ALA导致学习和记忆保持的明显改善[88],并且在ALA处理和未处理的Tg2576小鼠之间没有发现β-淀粉样蛋白水平的显著差异[89]。
3.3. α-硫辛酸与怀孕
考虑到ALA良好的抗氧化潜力及其对多种炎症的影响,最近的证据越来越强调其对生理过程的影响,如怀孕。有趣的是,Micili等人[90]评估了ALA在雌性Wistar大鼠阴道给药的影响,即测试其组织分布、对植入过程的影响以及对诱发早产的有效性。奇怪的是,作者发现,阴道给药的ALA吸收和分布良好,不影响植入过程,甚至能够明显逆转米非司酮加前列腺素E2的作用,从而推迟分娩时间,减少mRNA的合成和促炎性细胞因子的释放[90]。
4. 结论
ALA有各种好处,包括抗氧化潜力;然而,已经证明ALA的疗效受到限制,因为它的药代动力学特征有局限性。数据显示,由于涉及肝脏降解的机制,ALA的半衰期很短,生物利用度约为30%,ALA的溶解度降低,以及在胃中不稳定。然而,各种创新配方的使用已被证明能有效地提高ALA的生物利用率。通过研究表明,通过使用能够提高ALA在肠道中的可溶性和吸收性的两亲基质,ALA的生物利用度得到了提高。此外,与固体制剂相比,ALA液体制剂显示出更高的血浆浓度和生物利用率。此外,年龄也会影响ALA的生物利用度,而性别显示出不明显的差异。因此,能够促进ALA吸收的改进配方将明显提高ALA的生物利用度,最终导致疗效的提高。
从临床试验的数据来看,ALA在特定的疾病和条件下显示出高效性,包括糖尿病神经病变、肥胖症、精神分裂症、多发性硬化症、怀孕和器官移植中的异常情况,而且没有或只有轻微的不良反应。ALA似乎也是一种有前途的药剂,可以改善生活质量以及神经病变症状,甚至可以减少糖尿病神经病变患者通常使用的救援药物。此外,它还有可能改善脂质代谢,促进肥胖病人减轻体重,并减轻中枢神经系统相关疾病(精神分裂症和多发性硬化症)的症状。ALA还可以减少因应用处方抗精神病药物而引起的体重增加,以及精神分裂症患者的一些代谢风险因素。在多发性硬化症患者中,ALA有一些积极的结果,特别是在增强行走和平衡障碍方面,同时降低与多发性硬化症进展有关的一些促炎症因素的水平。因此,评估ALA效果的临床试验显示,它有能力缓解一些症状,这些症状通常在中枢神经系统疾病中发现,结果非常有希望。在威胁怀孕的情况下,ALA显示出对增强亚慢性血肿症状的有益作用,以及对预防流产的积极结果,而且没有不良反应。ALA对器官移植患者也很有效,它能降低炎症因子的水平,并对缺氧和氧化应激产生保护作用,而在细胞毒性化疗药物引起的神经毒性的情况下,ALA并不代表保护功能。综上所述,ALA可以被归类为预防或延缓某些疾病进展的候选分子之一。然而,为了研究ALA的治疗效果,必须设计更多的控制和强有力的临床试验。
5. 参考文献
为了增强阅读体验,参考文献部分被移到另外一个单独的文章。请参阅参考文章
α硫辛酸(Alpha-lipoic acid)也叫做硫辛酸或辛酸,是一种强大的抗氧化剂。它首次被科学家发现是在1937年,并在1951年被从体内分离出来[1][2], 距今已经过去将近100年。这100年来,科学家对它对人体的作用的研究一直没有间断过,新的生理作用每隔一段时间就会被发现;尤其是自2000以来,由于它在的肾的保护等方面的突出作用,再次成为了研究热点。本文回顾自2000年以来关于硫辛酸的研究进展,介绍硫辛酸(ALA)在糖尿病患者神经病变、肥胖症、中枢神经系统相关疾病和妊娠异常中的应用。